生化学研究室
シグナル伝達異常によって引き起こされる病態・疾患を理解する
ご挨拶
私達の身体は、異なる機能を持った細胞が集団を形成し、臓器を作り、様々な臓器が密に連絡をとることで生命活動が正常に働いています。もし、個々の細胞が勝手気ままな行動をとるようなことになると、個体のホメオスタシス(恒常性)が失われ、生命活動の破綻に繋がり、疾病・疾患を引き起こし、最悪な場合個体の死となります。私達は、個々の細胞が近傍の細胞とどのようにコミュニケーションをとり、互いに信頼関係を築いているかについて、遺伝子工学の技術を用いて解析しています。細胞間の信頼関係の築き方を理解することができれば、その破綻によって引き起こされる疾病・病態が理解できると考えております。また、細胞間の信頼関係構築をより良いものにするために「くすり」が必要となることもありますので、「くすり」の種(シーズといいます)を探し、創薬に繋がる研究も行っています。
研究概要
TGF-βファミリーシグナル異常がもたらす疾患の解明と新たな抗がん剤開発
私達は、なぜ様々な病気に罹患するのでしょうか?TGF-β (Transforming growth factor-β)ファミリーは、多彩な機能を持つサイトカインで、その生理作用は細胞増殖、細胞死、細胞分化、免疫調節、細胞運動等多岐に及んでいます。そのため、TGF-βファミリーシグナルに関与する分子の遺伝子異常は、様々な疾患を引き起こします。私達は、TGF-βシグナルの異常により引き起こされる疾患の分子メカニズムを解明することで、くすりの開発を通じて人間社会に少しでも貢献できるよう、日夜頑張っています。
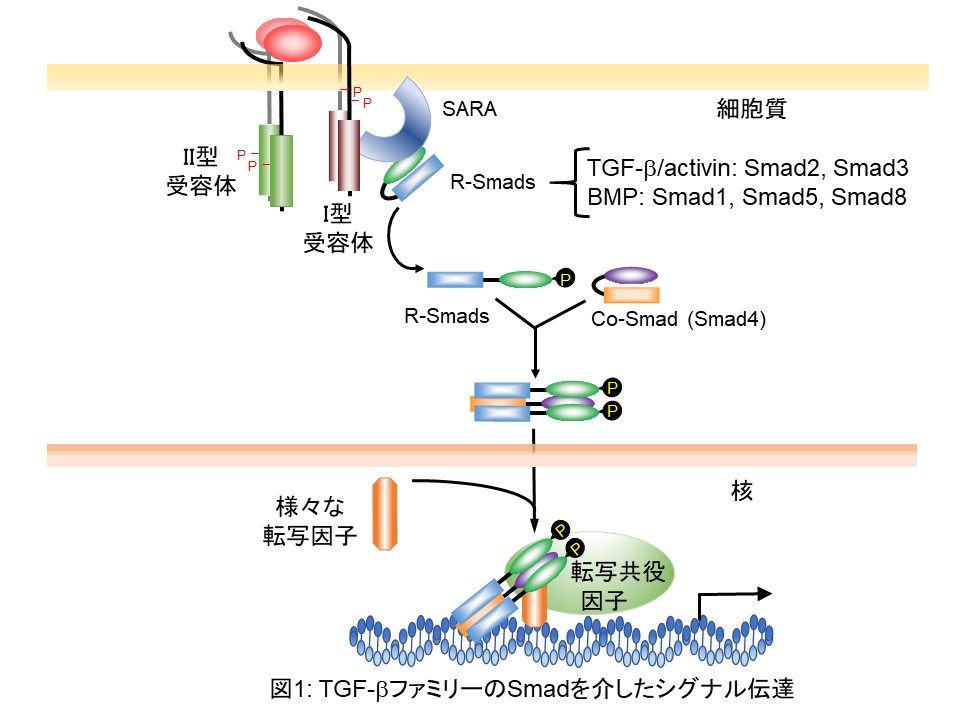
TGF-βは、細胞膜上に存在している膜貫通型受容体のTGF-β II型受容体とTGF-β I型受容体に結合します。TGF-β Ⅱ型並びにTGF-β Ⅰ型受容体は、共にその細胞内領域内にセリン・トレオニンキナーゼドメインを有しております。TGF-βがTGF-β Ⅱ型受容体と結合するとTGF-β Ⅱ型受容体セリン・トレオニンキナーゼがTGF-β Ⅰ型受容体の細胞膜直下に存在するセリンやトレオニンに富んだGSドメインとよばれる領域をリン酸化します。TGF-β Ⅰ型受容体がリン酸化されると、今まで不活性化状態で存在していたTGF-β Ⅰ型受容体セリン・トレオニンキナーゼが酵素活性を有するようになります。引き続き、Smad anchor for receptor activation (SARA) とよばれるアダプタータンパク質がTGF-βシグナル伝達分子の特異型Smad (receptor-regulated Smad; R-Smad) であるSmad2及びSmad3をセリン・トレオニンキナーゼ酵素活性を持つTGF-β Ⅰ型受容体に提示することで、R-SmadのC末端セリン残基をリン酸化します。リン酸化されたR-Smadは、共有型Smad (Common partner Smad; Co-Smad) のSmad4と3者複合体を形成し、核に移行し、直接また他の転写因子を介して間接的に、TGF-βシグナルの直接標的遺伝子プロモーター内の特異的DNA配列に結合し、標的遺伝子の転写を制御しています(図1)。
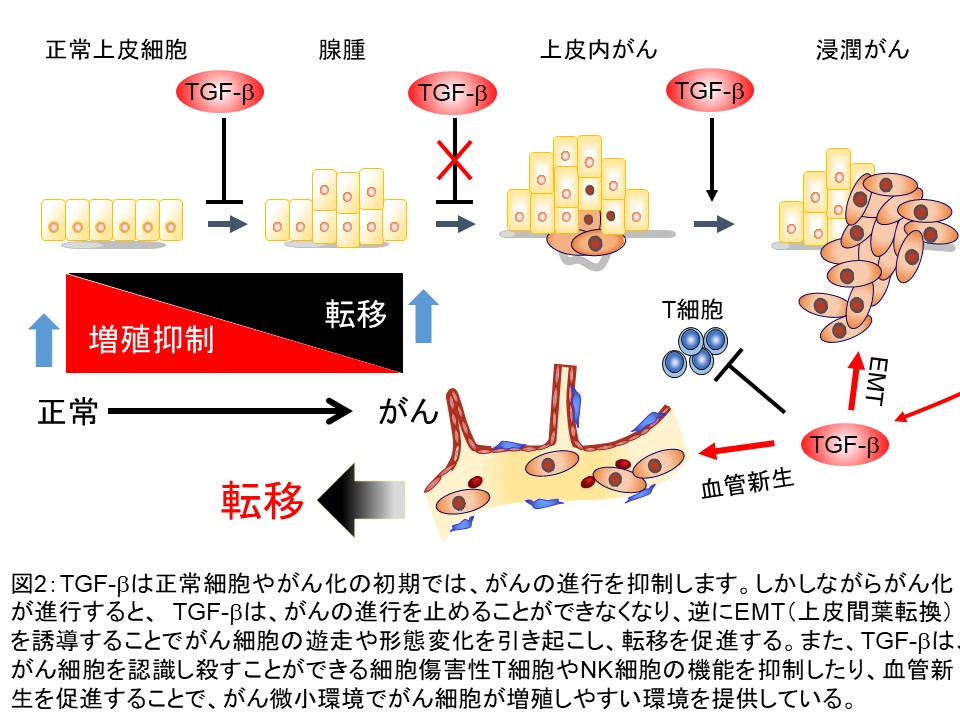
TGF-βは、がん化に関して二面性を有しているといわれています。正常上皮細胞やがん化初期の細胞は、TGF-βの持つ細胞増殖抑制作用により細胞増殖を抑制するので、がん細胞は増殖できません。一方、悪性化したがん細胞は、自らが多量に分泌したTGF-βがオートクライン(または他の近傍細胞からのパラクライン)によりEMT(上皮間葉転換)をおこすことで、運動能と共に転移能を獲得します。さらに、免疫監視システムを低下させることで、がん細胞が免疫監視システムから回避し、腫瘍内に新たな血管を作ること(腫瘍血管新生)を亢進し、がん細胞自身が増殖・転移しやすい微小環境を形成しています(図2)。
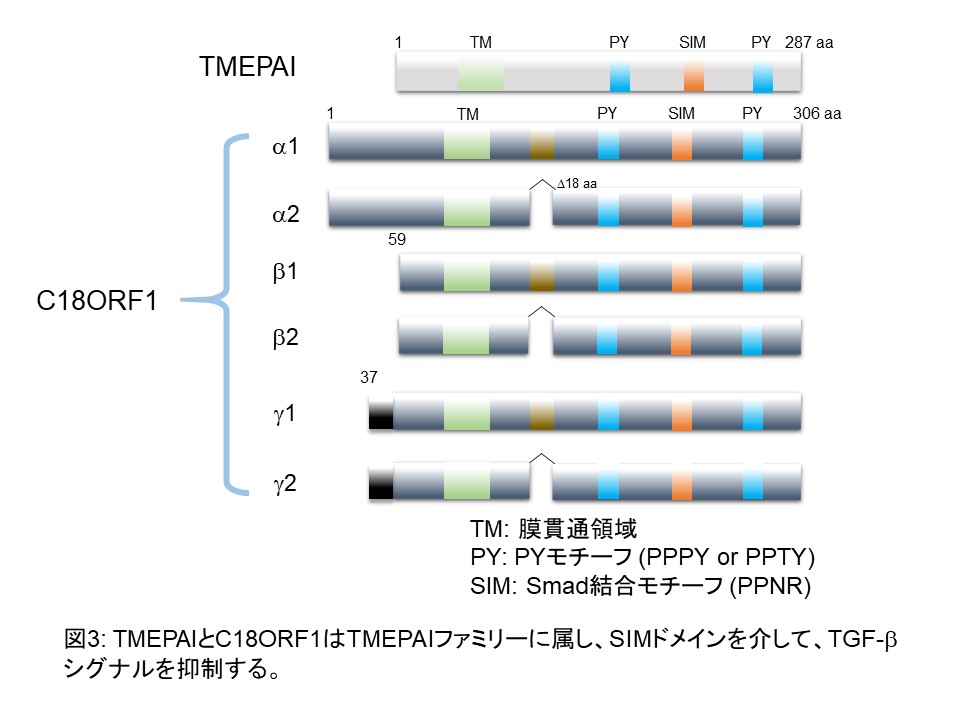
私たちは、TGF-βの直接の標的遺伝子の中で様々な腫瘍組織で発現が亢進していることが報告されているTMEPAI (TransMEmbrane Prostate Androgen-Induced RNA) 及びそのファミリー分子であるC18ORF1がTGF-βシグナルを特異的に抑制する分子について研究を行っています(図3)。TMEPAIとC18ORF1は、R-Smadとの結合に関してSARAと競合阻害することにより、SARAが充分量のR-SmadをTGF-βⅠ型受容体に提示できないようにします。そのためTGF-βⅠ型受容体セリンスレオニンキナーゼがR-Smadをリン酸化できなくなるために、TGF-βシグナルが抑制されるということを発見しました。
現在私たちは、このTMEPAIファミリーの機能をさらに詳細に検討し、TMEPAIががんの悪性化にどのように関与しているかを明らかにすべく、腫瘍形成を可視化、腸や乳腺のオルガノイド培養技術等を用いて、研究をしています。
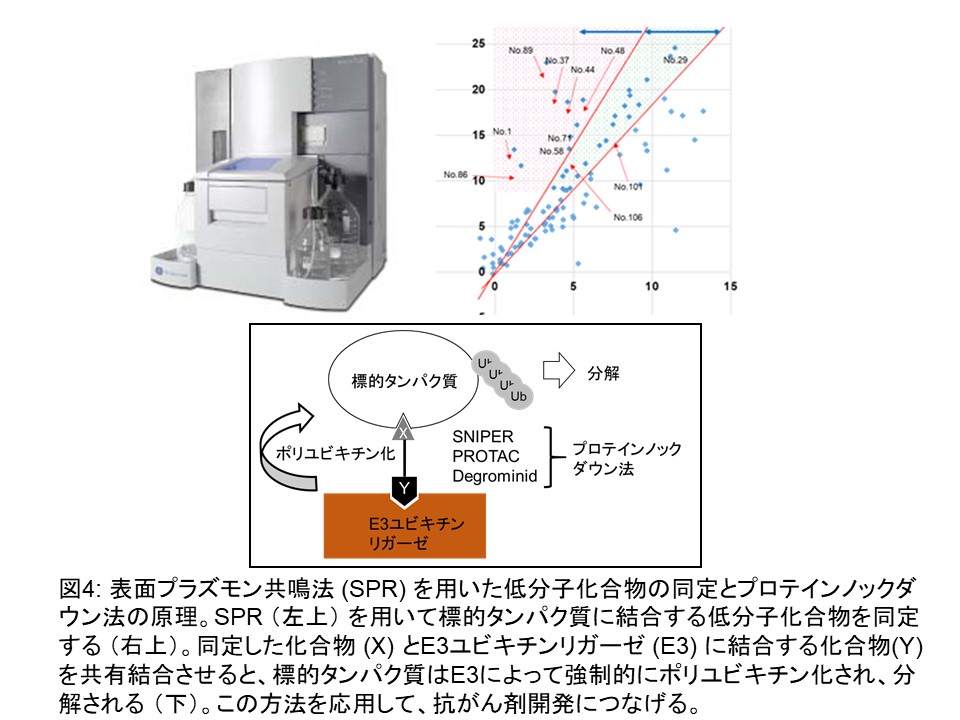
その他の研究として私たちは、抗がん剤のシーズを探索しています。例えば、がん細胞で高発現または異常な機能を持つようになったタンパク質に対する低分子化合物を見つけ、プロテインノックダウン法とよばれる新たな手法を用いた創薬を目指す研究です(図4)。
現在私たちの研究室で行っている研究内容は以下の通りです。
①TGF-βファミリーによるがん進展制御機構の解明
②EMTの分子メカニズムの解明と抗がん剤開発
③プロテインノックダウン法に利用できる低分子化合物の同定と創薬への応用
教員紹介
伊東 進 教授 / 学位:薬学博士
- 研究分野:TGF-βシグナルと疾患
- 担当科目:生化学Ⅰ(1年後期)
生化学Ⅱ(2年後期)
分子細胞生物学 (2年後期)
生化学実習 (2年後期)
分子生物学(3年前期)
分子病理学(4年後期)
薬学研究1(4年前期~5年後期)
薬学研究2(4年前期~5年後期)
基礎薬学総合演習(5年通年)
アドバンスト薬学研究 (6年前期)
薬学研究3(6年前期)
分子標的医薬品の創製 (6年前期)
最終総合演習(6年後期)
分子細胞生物学特論及び演習 (修士・博士)
先端薬学特論 (博士)
6年制薬学教育の傍ら、研究活動も行い、社会に還元できる研究成果を挙げることを目標に頑張っています。
中野 なおこ 講師 / 学位:博士(医学)
- 研究分野:TGF-βシグナルと疾患
- 担当科目:生物学実習 (1年後期)
分子細胞生物学 (2年後期)
生化学実習 (2年後期)
分子生物学 (3年前期)
薬学研究1 (4年前期~5年後期)
薬学研究2 (4年前期~5年後期)
総合薬学研究 (4年前期~6年前期)
もっと詳しく