科学的根拠に基づいた
レギュラトリーサイエンス研究
ご挨拶&どんな研究をしているの?
医薬品の品質、安全性及び有効性を正しく評価・検討するための調査・研究です。その成果が政策などに反映され、社会に貢献できることを目指しています。特に、医薬品による深刻な副作用を回避するための手段について研究しています。また、薬剤師による臨床上のエビデンス構築も推進しています。それらの成果が、人々の命を守り、健康保持に貢献・寄与することを目指しています。また、これらの研究を実践する事をとおして、科学的根拠に基づき、患者さん本位の視点で判断できる薬剤師の育成に、尽力していきたいと思っております。
研究の例:
・医薬品使用における安全対策に資する研究
・法律や制度の施行・変更に関連する分析・評価
・小児・難病・希少疾病の医薬品開発に資する研究
・医薬品の品質向上に資する研究
・規制国際調和に資する研究
・費用効果分析 など
解析のデータはどこから入手するの?
他研究機関との共同研究
国立成育医療研究センター
国立医薬品食品衛生研究所 など
オープンデータベース
JADER:医薬品副作用データベース
健康・医療NDBオープンデータ:レセプト情報・特定健診等情報データベース
医薬品副作用被害救済制度 支給決定情報
各種政府統計 など
その他
FAERS:米国FDA有害事象報告システム
JMDC Claims Database(レセプトデータベース) など
具体的な研究課題は?
より有効、安全で高い品質の医薬品使用を目指して
国が創設した制度の検証および改善点の提言等
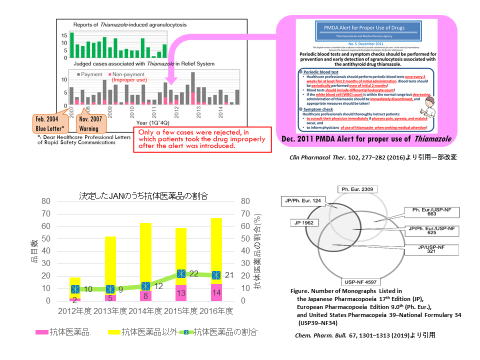
◆“RMP(医薬品の開発から市販後に至るまでの一貫したリスク管理計画)のライフサイクルマネジメント”についてPDCAサイクルの実行
副作用の更なる低減のため、薬局薬剤師を含めたリスク管理計画実践の検討
◆「患者副作用報告制度」(副作用情報収集のためH30年から開始)のPDCAサイクルの実行
-薬剤師・患者へのアンケート調査を活用した実体調査および啓蒙活動の推進
◆日米欧三薬局方等の国際比較研究他
-医薬品品質リスクマネージメントにおける国際調和についての解析
◆医薬品の適応ラグに関する日米欧の比較検討についての解析
◆医薬品の国際一般名(INN)等を用いた医薬品開発動向の解析
社会における課題の抽出と解決策の構築
◆小児・妊婦・授乳婦の医薬品使用における安全性の確保
-薬物治療にかかわるデータ分析・評価
-患者に望まれる薬剤師によるサポートの検討
◆重篤副作用の発現状況の解析および対処方法の構築
抗体医薬品、抗がん剤、向精神薬 他
◆疾病予防に関する費用効果分析
2016年より活動を開始している研究室です。4,5,6年次の学生さんに加えて、社会人大学院生や研究生・研究員の方々含め賑やかに活動しています。
ご興味のある方は、いつでもお声がけ下さい!